티스토리 뷰

1. 결합세기 화학결합(이온결합) > 분자결합 (수소결합, 쌍극자 힘)
2. H와 F, O, N의 결합이 수소결합

3. 결합은 역시 이온결합이 1등!
이온-쌍극자결합 (인력)
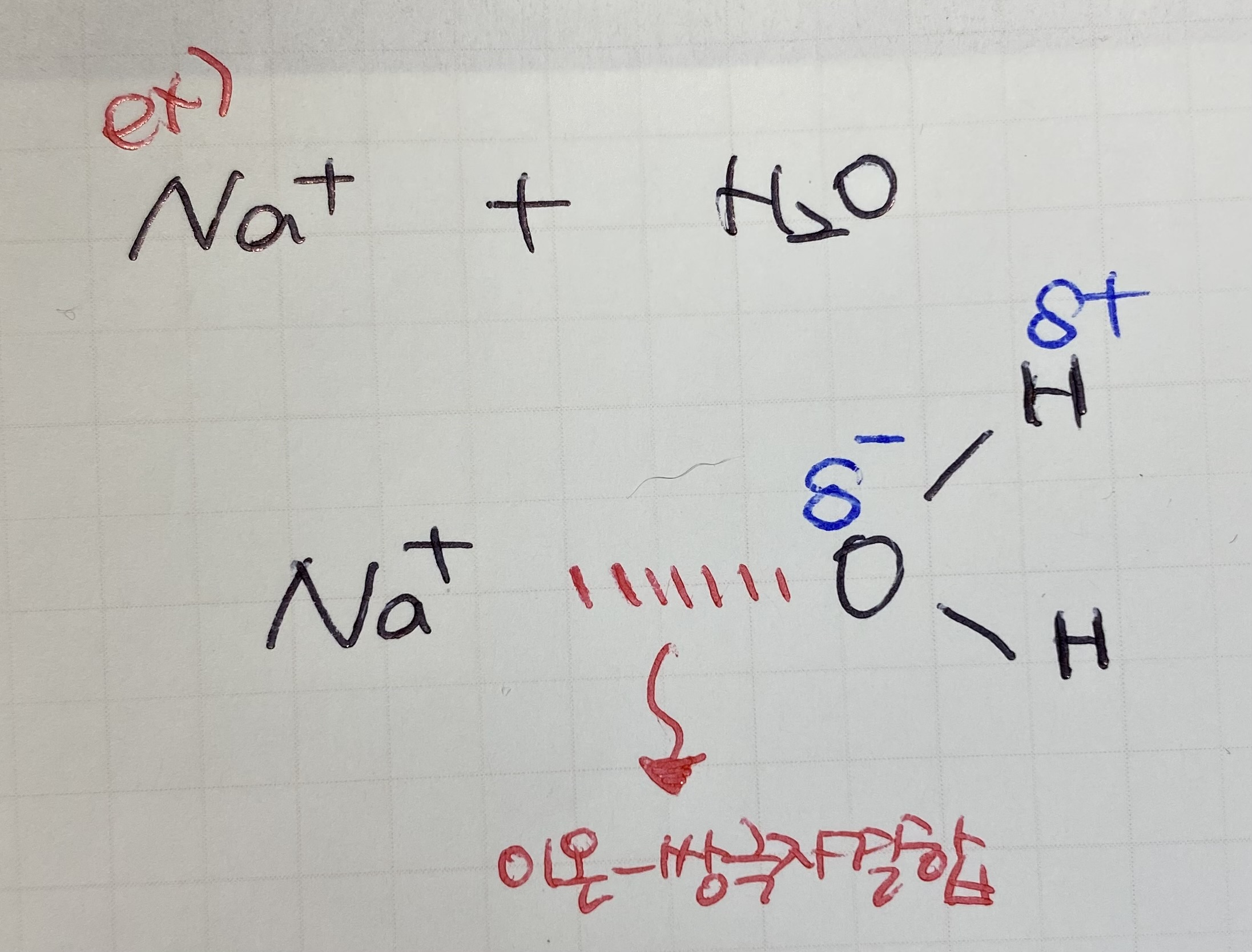
London force : 분산력, 젤 작은 힘
*가끔 쌍극자-쌍극자 힘이 London force보다 클 때도 있긴 하지만 어차피 작은 애들끼리의 싸움이라 크게 차이 없음
4. 힘세기 : 화학결합 >> 분자결합 중 수소결합 > 분자결합
Ca : 금속결합 고체 (화학결합)
C : 그물형 공유 (화학결합)
CaC₂ : 이온결합 (화학결합)
CO₂ : 분자결합
H₂O : 분자결합 중 수소결합
5. 끓는점 : 상호간의 인력 = 반데르발스힘
6. 수소결합 >> 분산력크기순
분산력 = 질량비례
7. 분자결합 중 가장 강한 것은 역시 수소결합!
8. 모두 다 분자결합 (공유결합)인데 그 중 수소결합이 있으면 독보적이지
C₂H5OH : OH가 바로 수소결합
9. H₂O, H₂S 모두 굽은형
10. 물이 고체가 될 때 특이함
부피 V : 액체 < 고체
밀도 d : 액체 > 고체
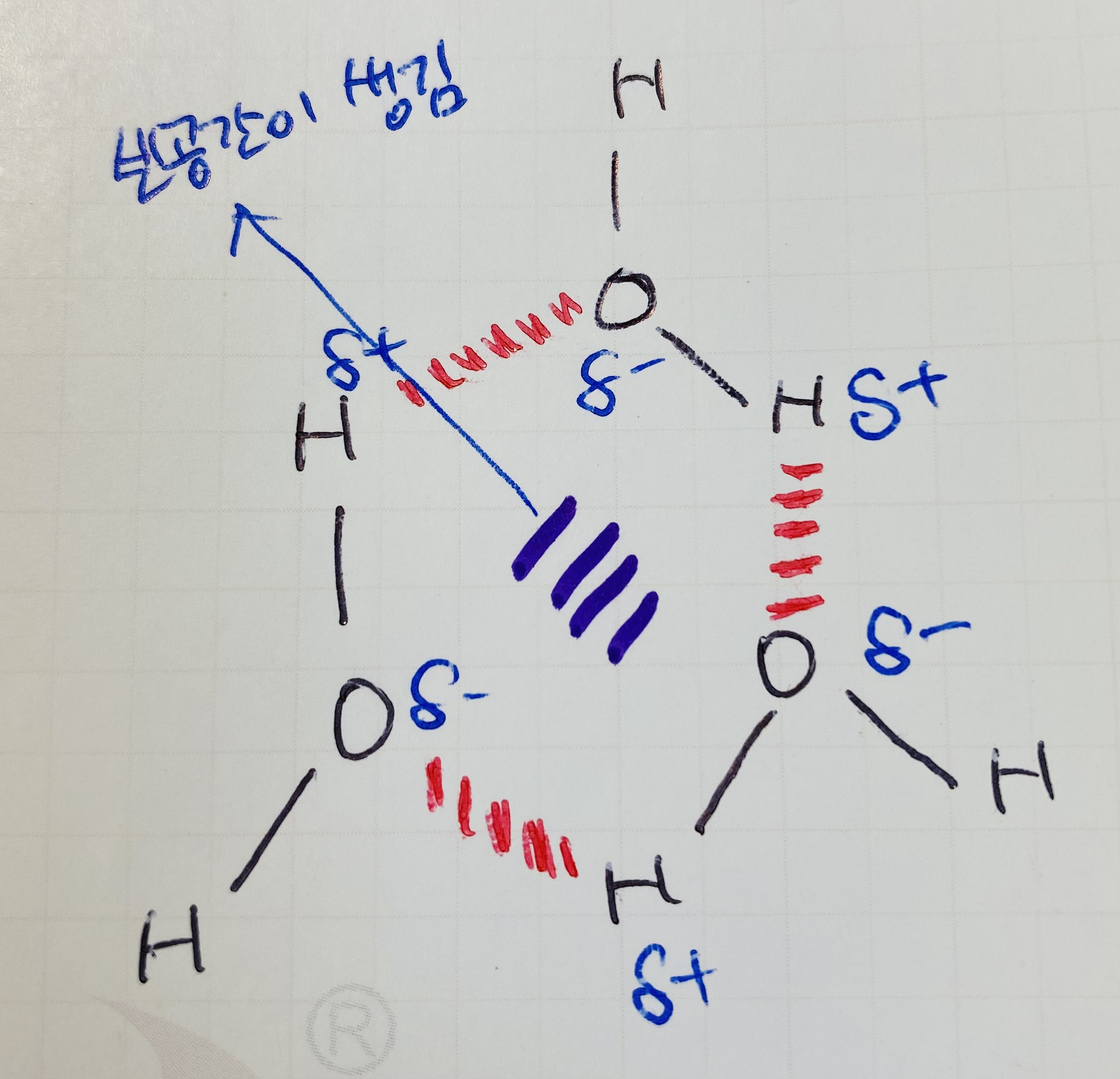
11.
이온결합 : 금속 + 비금속
CH₃OH : CH사이의 공유결합, OH 수소결합, 금속이 없어서 이온결합 불가능
Na₂CO₃ : Na+ 이온결합, CO사이의 공유결합
NH₄Cl : NH₄+ 이온으로 생기는 이온결합, NH 사이의 공유결합
KCl : 이온결합
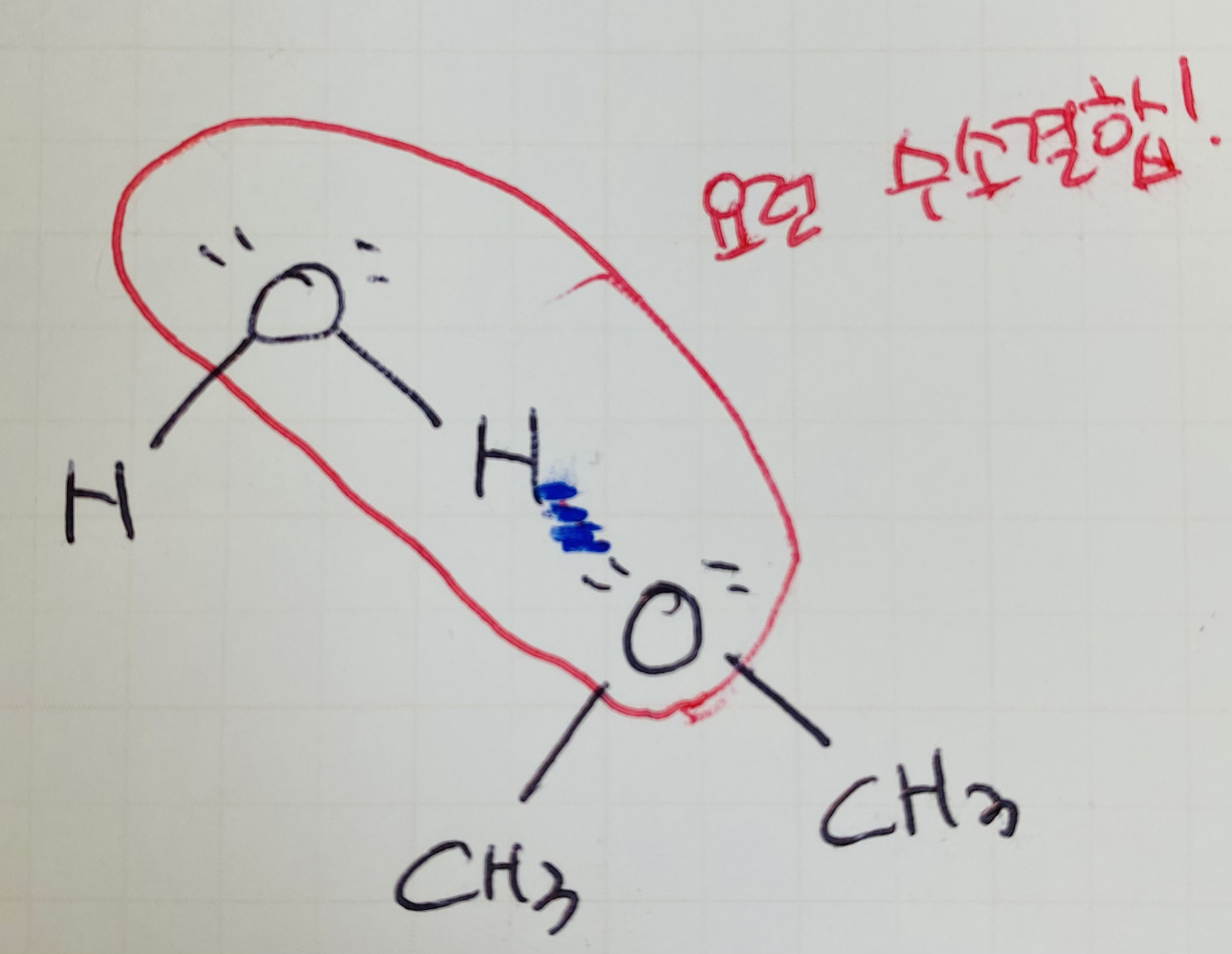
12. F, O, N과 수소가 만나는 게 공유결합
물이니까 물의 H(델타+)와 만날 O, F, N의 비공유 전자쌍(델타-)이 있거나
물의 O(델타-)와 만날 H(델타+)가 있거나
물의 H+와 만날 F, O, N이 있거나
HF, HO, HN 이 있거나
이런애들을 찾아야 함
13.
우선순위 1. 수소결합 있느냐?
우선순위 2. 분자량 누가 더 크냐?
--> 끓는점이 높다
14. 증발열 = 끓는점 --> 분산력
O₂ 분자량 32
Ne 분자량 20
CH₃OH 분자량 32, OH 수소결합, 쌍극자-쌍극자 힘이 있음 (극성이므로)
15. 수소결합수 多 --> 분산력 大
16. 체심입방
센터 1개 + 모서리 1/8 * 꼭지점8개 = 원자수2
배위수는 1개의 원자가 이을 수 있는 갯수를 말함,
체심원자 하나가 위의 꼭지점 4개, 아래 꼭지점 4개 총 8개와 만남
18. 모서리란? 입방체를 구성하는 12개의 변을 말함
(ㅠㅠ 아니 보통 모서리는 구석 말하는 거 아냐?)
음이온 : 중앙1개 + 각모서리 군데 12* 1/4 = 4
양이온 : 6면 * 1/2 = 3
면심입방 배위수는 12 (복잡하니 암기 추천)
윗(xy축)의 가로변에 원자 4개
중앙(yz 또는 xz축) 세로변에 원자 4개
아래 (xy축)의 가로변에 원자 4개
20. 체심입방 원자수 2
밀도는 23 g/cm³, 원자량이 23 g/mol
--> 소듐기본원자량이 23인데 얘는 체심입방 원자수만큼 2배 즉 46g이 있어야 함,
근데 23 g밖에 없으니... 적정량의 1/2 밖에 없구나.
단위세포당 부피 => 단위부피/1개 => 1cm³/0.5mol만큼의 갯수
1mol에는 6.02*10^23개
21. 면심입방 빗변 a, 삼각형의 가로 2r, 세로 2r, a² = 4r² + 4r² = 8r²
a = 2√2r
22. 면심입방 원자수 = 1/8*8 + 1/2*6 = 4
23. 상평형 그래프에서는 가로축에 평행한 선을 그어
가장 온도가 낮은데부터 고체 -> 액체 -> 기체 로 흘러갈 수 있게 한다
24. 삼중점 그래프 그리고 대입해보라.
삼중점 그래프가 물> (일반적인 물질) 다르다옹!!!
왜? 물은 고체가 밀도가 낮은 특성이 있으니까
25. 세포당원자수, 배위수, A와 R의 관계, 밀도 등등 암기해라
단순/체심/면심
'화학' 카테고리의 다른 글
| 원동신_편입기본_6강 (0) | 2021.12.17 |
|---|---|
| 원동신_편입기본_5강 (0) | 2021.12.14 |
| 원동신_편입기본_3강 (0) | 2021.12.11 |
| 원동신_편입기본_2강 (0) | 2021.12.09 |
| 원동신_편입기본_1강 (1) | 2021.12.07 |
